PREVYMIS 240 mg, solution à diluer pour perfusion, boîte de 1 flacon de 12 ml
Dernière révision : 15/11/2023
Taux de TVA : 2.1%
Laboratoire exploitant : MSD FRANCE
PREVYMIS est indiqué dans la prophylaxie de la réactivation du cytomégalovirus (CMV) et de la maladie à CMV chez les adultes séropositifs au CMV receveurs [R+] d'une greffe allogénique de cellules souches hématopoïétiques (GCSH).
PREVYMIS est indiqué dans la prophylaxie de la maladie à CMV chez les adultes séronégatifs au CMV ayant reçu une greffe rénale d'un donneur séropositif au CMV [D+/R-].
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des agents antiviraux.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Administration concomitante avec le pimozide (voir rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Administration concomitante avec des alcaloïdes de l'ergot de seigle (voir rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Administration concomitante avec le millepertuis (Hypericum perforatum) (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Lorsque le letermovir est associé à la ciclosporine :
L'utilisation concomitante de dabigatran, d'atorvastatine, de
simvastatine, de rosuvastatine ou de pitavastatine est contre-indiquée
(voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Surveillance de l’ADN du CMV chez les receveurs de GCSH
Lors d’un essai de phase 3 (P001), la sécurité et l’efficacité du letermovir ont été établies chez des patients GCSH présentant un résultat négatif au test ADN du CMV avant initiation de la prophylaxie.
L’ADN du CMV a été surveillé chaque semaine jusqu’à la Semaine 14 post-greffe, et ensuite toutes les 2 semaines jusqu’à la Semaine 24. En cas d’ADNémie ou de maladie à CMV cliniquement significative, la prophylaxie par le letermovir était arrêtée et une thérapie préemptive standard (PET) ou un traitement était instauré. Pour les patients chez lesquels la prophylaxie par letermovir était instaurée et dont le test ADN du CMV à l’inclusion s’est révélé positif par la suite, la prophylaxie pouvait être poursuivie si les critères d’initiation de la PET n’étaient pas remplis (voir rubrique Propriétés pharmacodynamiques).
Risque d'effets indésirables ou d'effet thérapeutique diminué en raison d'interactions médicamenteuses
L'utilisation concomitante de PREVYMIS avec certains médicaments peut donner lieu à des interactions médicamenteuses connues ou potentiellement significatives, dont certaines peuvent entraîner :
- de possibles effets indésirables cliniquement significatifs liés à une exposition accrue aux traitements concomitants ou au letermovir.
- une diminution significative des concentrations plasmatiques du traitement concomitant, qui peut entraîner un effet thérapeutique moindre du traitement concomitant.
Se reporter au Tableau 1 concernant les mesures de prévention ou de gestion de ces interactions médicamenteuses connues ou potentiellement significatives, incluant des recommandations posologiques (voir rubriques Contre-indications et Interactions avec d'autres médicaments et autres formes d'interactions).
Interactions médicamenteuses
PREVYMIS doit être utilisé avec prudence avec des médicaments qui sont des substrats du CYP3A à marge thérapeutique étroite (par ex. alfentanil, fentanyl et quinidine), car l'administration concomitante peut entraîner des élévations des concentrations plasmatiques des substrats du CYP3A. Une surveillance étroite et/ou un ajustement posologique des substrats du CYP3A co-administrés est recommandé (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Une surveillance accrue de la ciclosporine, du tacrolimus, du sirolimus est généralement recommandée les 2 premières semaines après l'initiation et l'arrêt du letermovir (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions) ainsi qu'après changement de la voie d'administration du letermovir.
Le letermovir est un inducteur modéré des enzymes et des transporteurs. L'induction peut entraîner une réduction des concentrations plasmatiques de certains médicaments métabolisés et transportés (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). Un suivi thérapeutique pharmacologique (STP) est donc recommandé pour le voriconazole. L'utilisation concomitante de dabigatran doit être évitée en raison du risque de baisse de l'efficacité du dabigatran.
Le letermovir peut augmenter les concentrations plasmatiques des médicaments transportés par les OATP1B1/3 tels que la plupart des statines (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions et Tableau 1).
Administration à travers un filtre en ligne stérile en PES de 0,2 microns ou 0,22 microns
PREVYMIS solution à diluer pour perfusion peut contenir quelques petites particules translucides ou blanches liées au produit. L'administration de la solution diluée de PREVYMIS exige toujours l'utilisation d'un filtre en ligne stérile en PES de 0,2 microns ou 0,22 microns, que ces particules liées au produit soient visibles ou non dans le flacon ou dans la solution diluée (voir rubriques Posologie et mode d'administration et Instructions pour l'utilisation, la manipulation et l'élimination).
Excipients
Sodium
Ce médicament contient 23 mg (soit 1 mmol) de sodium par flacon de 240 mg, équivalent à 1,15 % de la prise maximale quotidienne de sodium de 2 g recommandée pour un adulte par l’OMS. Ceci doit être pris en compte chez les patients suivant un régime contrôlé en sodium.
Ce médicament contient 46 mg (soit 2 mmol) de sodium par flacon de 480 mg, équivalent à 2,30 % de la prise maximale quotidienne de sodium de 2 g recommandée pour un adulte par l’OMS. Ceci doit être pris en compte chez les patients suivant un régime contrôlé en sodium.
Cyclodextrine
Ce médicament contient 1800 mg d’hydroxypropylbetadex (cyclodextrine) par flacon de 12 mL (dose de 240 mg).
Ce médicament contient 3600 mg d'hydroxypropylbetadex (cyclodextrine) par flacon de 24 mL (dose de 480 mg)
Ce médicament contient 23 mg (soit 1 mmol) de sodium par flacon de 240 mg, équivalent à 1,15 % de la prise maximale quotidienne de sodium de 2 g recommandée pour un adulte par l’OMS. Ceci doit être pris en compte chez les patients suivant un régime contrôlé en sodium.
Ce médicament contient 46 mg (soit 2 mmol) de sodium par flacon de 480 mg, équivalent à 2,30 % de la prise maximale quotidienne de sodium de 2 g recommandée pour un adulte par l’OMS. Ceci doit être pris en compte chez les patients suivant un régime contrôlé en sodium.
Cyclodextrine
Ce médicament contient 1800 mg d’hydroxypropylbetadex (cyclodextrine) par flacon de 12 mL (dose de 240 mg).
Ce médicament contient 3600 mg d'hydroxypropylbetadex (cyclodextrine) par flacon de 24 mL (dose de 480 mg)
Résumé du profil de sécurité
L'évaluation de la sécurité de PREVYMIS a reposé sur trois études cliniques de phase 3.
GCSH
Dans l'étude P001, 565 receveurs d'une GCSH ont été traités par PREVYMIS ou par placebo jusqu'à la Semaine 14 post-greffe et ont fait l'objet d'un suivi de tolérance jusqu'à la Semaine 24 post-greffe (voir rubrique Propriétés pharmacodynamiques). Les effets indésirables les plus fréquemment rapportés, survenant chez au moins 1 % des patients du groupe PREVYMIS et à une fréquence supérieure à celle du placebo étaient : nausées (7,2 %), diarrhée (2,4 %) et vomissements (1,9 %). Les effets indésirables les plusfréquemment rapportés qui ont conduit à l'arrêt de PREVYMIS étaient : nausées (1,6 %), vomissements (0,8 %) et douleur abdominale (0,5 %).
Dans l'étude P040, 218 receveurs d'une GCSH ont été traités par PREVYMIS ou par placebo de la semaine 14 (~ 100 jours) à la semaine 28 (~ 200 jours) post-GCSH et ont fait l'objet d'un suivi de tolérance jusqu'à la semaine 48 post-GCSH (voir rubrique Propriétés pharmacodynamiques). Les effets indésirables rapportés étaient cohérents avec le profil de sécurité d'emploi de PREVYMIS tel que caractérisé dans l'étude P001.
Greffe rénale
Dans l'étude P002, 292 receveurs de greffe rénale ont été traités par PREVYMIS jusqu'à la semaine 28 (~ 200 jours) post-greffe (voir rubrique Propriétés pharmacodynamiques).
Liste tabulée des effets indésirables
Les effets indésirables suivants ont été identifiés chez des patients prenant PREVYMIS dans les études cliniques. Les effets indésirables sont présentés ci-dessous par classe de systèmes d'organes et fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000) ou très rare (< 1/10 000).
Tableau 2 : Effets indésirables identifiés avec PREVYMIS
| Fréquence | Effets indésirables |
| Affections du système immunitaire | |
| Peu fréquent | hypersensibilité |
| Troubles du métabolisme et de la nutrition | |
| Peu fréquent | diminution de l'appétit |
| Affections du système nerveux | |
| Peu fréquent | disgueusie, céphalées |
| Affections de l'oreille et du labyrinthe | |
| Peu fréquent | vertige |
| Affections gastro-intestinales | |
| Fréquent | nausées, diarrhée, vomissements |
| Peu fréquent | douleur abdominale |
| Affections hépatobiliaires | |
| Peu fréquent | élévation de l'alanine aminotransférase, élévation de l'aspartate aminotransférase |
| Affections musculo-squelettiques et systémiques | |
| Peu fréquent | spasmes musculaires |
| Affections du rein et des voies urinaires | |
| Peu fréquent | élévation de la créatinine sanguine |
| Troubles généraux et anomalies au site d'administration | |
| Peu fréquent | fatigue, œdème périphérique |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
NE PAS CONSOMMER de préparations à base de plantes contenant du millepertuis (Hypericum perforatum).
PRUDENCE en cas de conduite de véhicules ou d'utilisation de machines (fatigue, vertiges).
Grossesse
Aucune donnée n'est disponible sur l'utilisation du letermovir chez la femme enceinte. Les études chez l'animal ont montré une toxicité sur la reproduction (voir rubrique Données de sécurité précliniques).
PREVYMIS n'est pas recommandé pendant la grossesse ni chez la femme en âge de procréer n'utilisant pas de contraception.
Allaitement
On ne sait pas si le letermovir est excrété dans le lait maternel.
Les données pharmacodynamiques/toxicologiques disponibles chez l'animal
ont mis en évidence l'excrétion de letermovir dans le lait (voir
rubrique Données de sécurité précliniques).
Un risque pour les nouveau-nés/nourrissons ne peut être exclu.
Une décision doit être prise soit d'interrompre l'allaitement soit
d'interrompre/de s'abstenir du traitement par PREVYMIS en prenant en
compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice
du traitement pour la femme.
Fertilité
Aucun effet n'a été observé sur la fertilité des rats femelles. Une toxicité testiculaire irréversible et une altération de la fertilité ont été observées chez les rats mâles, mais pas chez les souris mâles ni chez les singes mâles.
Informations générales sur les différences d'exposition entre les différents schémas thérapeutiques du letermovir :
- L'exposition plasmatique estimée au letermovir est différente en fonction du schéma posologique utilisé (voir tableau en rubrique Propriétés pharmacocinétiques). Les conséquences cliniques des interactions médicamenteuses pour le letermovir dépendront donc du schéma posologique utilisé pour le letermovir et de l'association ou non du letermovir avec la ciclosporine.
- L'association de la ciclosporine et du letermovir peut conduire à des effets plus marqués ou additionnels sur les médicaments concomitants par rapport au letermovir seul (voir Tableau 1).
Effets d'autres médicaments sur le letermovir
In vivo, le letermovir est éliminé par excrétion biliaire et glucuronidation. L'importance relative de ces voies d'élimination est inconnue. Les deux voies d'élimination impliquent une absorption active dans l'hépatocyte par les transporteurs de captation hépatique OATP1B1/3. Après absorption, la glucuronidation du letermovir est médiée par les UGT1A1 et 3. Le letermovir semble aussi soumis aux efflux médiés par la P-gp et la BCRP dans le foie et les intestins (voir rubriquePropriétés pharmacocinétiques).
Inducteurs des enzymes qui métabolisent les médicaments ou transporteurs
La co-administration de PREVYMIS (avec ou sans ciclosporine) avec des inducteurs puissants et modérés des transporteurs (ex., P-gp) et/ou des enzymes (ex., UGTs) n'est pas recommandée car elle peut conduire à une exposition subthérapeutique au letermovir (voir tableau 1).
- La rifampicine, la phénytoïne, la carbamazépine, le millepertuis (Hypericum perforatum), la rifabutine et le phénobarbital sont des exemples d'inducteurs puissants.
- La thioridazine, le modafinil, le ritonavir, le lopinavir, l'éfavirenz et l'étravirine sont des exemples d'inducteurs modérés.
L'administration concomitante de rifampicine a entraîné une augmentation initiale des concentrations plasmatiques du letermovir (en raison de l'inhibition des OATP1B1/3 et/ou de la P-gp) qui n'est pas cliniquement pertinente, suivie par une diminution cliniquement pertinente des concentrations plasmatiques du letermovir (en raison de l'induction de la P-gp/UGT) avec une co-administration continue de rifampicine (voir tableau 1).
Effets additionnels d'autres produits sur le letermovir en cas d'association avec la ciclosporine
Inhibiteurs des OATP1B1 ou 3
L'administration concomitante de PREVYMIS avec des médicaments inhibiteurs des transporteurs OATP1B1/3 peut entraîner des concentrations plasmatiques augmentées de letermovir. Si PREVYMIS est administré simultanément à la ciclosporine (un puissant inhibiteur des OATP1B1/3), la dose recommandée de PREVYMIS est de 240 mg une fois par jour (voir Tableau 1 et rubriques Posologie et mode d'administration et Propriétés pharmacocinétiques). La prudence est conseillée lorsque d'autres inhibiteurs des OATP1B1/3 sont ajoutés au letermovir associé à la ciclosporine.
- Le gemfibrozil, l'érythromycine, la clarithromycine, et plusieurs inhibiteurs de la protéase (atazanavir, siméprévir) sont des exemples d'inhibiteurs des OATP1B1.
Inhibiteurs de la P-gp/BCRP
Des résultats in vitro montrent que le letermovir est un substrat de la P-gp/BCRP. Les modifications des concentrations plasmatiques du letermovir dues à une inhibition de la P-gp/BCRP par l'itraconazole n'ont pas été cliniquement pertinentes.
Effet du letermovir sur d'autres médicaments
Médicaments principalement éliminés par métabolisme ou influencés par transport actif
In vivo, le letermovir est un inducteur général des enzymes et des transporteurs. A moins qu'une enzyme ou un transporteur particulier ne soit inhibé (voir ci-dessous), une induction peut être attendue. Par conséquent, le letermovir peut potentiellement conduire à diminuer l'exposition plasmatique et possiblement réduire l'efficacité des médicaments co-administrés qui sont principalement éliminés par métabolisme ou par transport actif.
L'importance de l'effet d'induction dépend de la voie d'administration du letermovir et de l'utilisation concomitante ou non de ciclosporine. L'effet maximal de l'induction peut être attendu après 10 à 14 jours de traitement par letermovir. Le temps nécessaire pour atteindre l'état d'équilibre d'un médicament spécifique affecté aura également une influence sur le temps nécessaire pour atteindre l'effet maximal sur les concentrations plasmatiques.
In vitro, le letermovir est un inhibiteur des CYP3A, CYP2C8, CYP2B6, BCRP, UGT1A1, OATP2B1, et OAT3 à des concentrations pertinentes in vivo. Des études in vivo sont disponibles pour étudier l'effet net sur le CYP3A4, la P-gp, les OATP1B1/3 en plus du CYP2C19. L'effet net in vivo sur les autres enzymes et transporteurs listés n'est pas connu. Des informations détaillées sont présentées ci- dessous.
On ne sait pas si le letermovir peut affecter l'exposition de la piperacilline/tazobactam, de l'amphotéricine B et de la micafungine. L'interaction potentielle entre le letermovir et ces médicaments n'a pas été étudiée. Il existe un risque théorique d'exposition réduite en raison de l'induction mais l'amplitude de l'effet et donc la pertinence clinique est actuellement inconnue.
Médicaments métabolisés par le CYP3A
In vivo, le letermovir est un inhibiteur modéré du CYP3A. L'administration concomitante de PREVYMIS avec le midazolam par voie orale (un substrat du CYP3A) entraîne une élévation de 2 à 3 fois des concentrations plasmatiques de midazolam. L'administration concomitante de PREVYMIS peut provoquer des augmentations cliniquement pertinentes des concentrations plasmatiques des substrats du CYP3A administrés simultanément (voir rubriquesContre-indications, Mises en garde et précautions d'emploi et Propriétés pharmacocinétiques).
- Certains immunosuppresseurs (par ex la ciclosporine, le tacrolimus, le sirolimus), les inhibiteurs de la HMG CoA réductase, et l'amiodarone sont des exemples de ces médicaments (voir Tableau 1). Le pimozide et les alcaloïdes de l'ergot de seigle sont contre-indiqués (voir rubrique Contre-indications).
L'importance de l'effet inhibiteur du CYP3A dépend de la voie d'administration du letermovir et de l'utilisation concomitante ou non de la ciclosporine.
En raison de l'inhibition dépendante du temps et de l'induction simultanée, l'effet net des enzymes inhibitrices peut ne pas être atteint avant 10 à 14 jours. Le temps nécessaire pour atteindre l'état d'équilibre d'un médicament spécifique affecté aura également une influence sur le temps nécessaire pour atteindre l'effet optimal sur les concentrations plasmatiques. A la fin du traitement, l'effet inhibiteur disparaît après 10-14 jours. Si une surveillance est mise en place, celle-ci est recommandée les 2 premières semaines après initiation et arrêt du letermovir (voir rubrique Mises en garde et précautions d'emploi) ainsi qu'après chaque changement de voie d'administration de letermovir.
Médicaments transportés par les OATP1B1/3
Le letermovir est un inhibiteur des transporteurs OATP1B1/3. L'administration de PREVYMIS peut provoquer une augmentation cliniquement pertinente des concentrations plasmatiques des médicaments co-administrés qui sont des substrats des OATP1B1/3.
- Les inhibiteurs de la HMG-CoA réductase, la fexofénadine, le répaglinide et le glyburide sont des exemples de ces médicaments (voir Tableau 1). En comparant les schémas thérapeutiques du letermovir administrés sans ciclosporine, l'effet est plus marqué après administration intraveineuse de letermovir qu'après administration orale.
Il est probable que l'amplitude de l'inhibition des OATP1B1/3 sur les médicaments co-administrés soit plus importante quand PREVYMIS est co-administré avec la ciclosporine (un puissant inhibiteur des OATP1B1/3). Ceci est à prendre en compte lorsque le schéma thérapeutique du letermovir est modifié pendant le traitement avec un substrat des OATP1B1/3.
Médicaments métabolisés par le CYP2C9 et/ou le CYP2C19
L'administration concomitante de PREVYMIS avec le voriconazole (un substrat du CYP2C19) entraîne une diminution significative des concentrations plasmatiques du voriconazole, indiquant que le letermovir est un inducteur du CYP2C19. Il est probable que le CYP2C9 soit également induit. Le letermovir peut potentiellement diminuer l'exposition des substrats du CYP2C9 et/ou du CYP2C19, pouvant entraîner des doses inférieures aux seuils thérapeutiques.
- La warfarine, le voriconazole, le diazépam, le lansoprazole, l'oméprazole, l'ésoméprazole, le pantoprazole, la tilidine, le tolbutamide sont des exemples de ces médicaments (voir Tableau 1). Il est attendu que l'effet du letermovir par voie orale sans ciclosporine soit moins prononcé que celui du letermovir par voie intraveineuse avec ou sans ciclosporine, ou celui du letermovir par voie orale avec ciclosporine. Ceci est à prendre en compte lorsque le schéma thérapeutique du letermovir est modifié pendant le traitement avec un substrat du CYP2C9 ou CYP2C19. Voir également les informations générales ci-dessus sur l'induction concernant les durées de cette interaction.
Médicaments métabolisés par le CYP2C8
In vitro, le letermovir inhibe le CYP2C8 mais peut aussi induire le CYP2C8 grâce à son potentiel inducteur. In vivo l'effet net est inconnu.
- Le répaglinide est un exemple de médicament qui est principalement éliminé par le CYP2C8 (voir Tableau 1). L'utilisation concomitante du répaglinide et du letermovir avec ou sans ciclosporine n'est pas recommandée.
Médicaments transportés par la P-gp dans les intestins
Le letermovir est un inducteur de la P-gp intestinale. L'administration de PREVYMIS peut entraîner une diminution cliniquement pertinente des concentrations plasmatiques des médicaments co- administrés qui sont significativement transportés par la P-gp dans les intestins, tels que le dabigatran et le sofosbuvir.
Médicaments métabolisés par les CYP2B6, UGT1A1 ou transportés par la BCRP ou l'OATP2B1
In vivo, le letermovir est un inducteur général mais il a également été observé comme inhibiteur des CYP2B6, UGT1A1, BCRP et OATP2B1 in vitro. L'effet net in vivo est inconnu. Par conséquent, les concentrations plasmatiques des médicaments qui sont des substrats de ces enzymes ou de ces transporteurs peuvent augmenter ou diminuer lorsqu'ils sont co-administrés avec le letermovir. Une surveillance supplémentaire peut être recommandée ; se référer au RCP pour ces médicaments.
- Le bupropion est un exemple de médicaments métabolisés par le CYP2B6.
- Le raltégravir et le dolutégravir sont des exemples de médicaments métabolisés par l'UGT1A1.
- La rosuvastatine et la sulfasalazine sont des exemples de médicaments transportés par la BCRP.
- Le céliprolol est un exemple de médicament transporté par l'OATP2B1.
Médicaments transportés par le transporteur rénal OAT3
Les données in vitro indiquent que le letermovir est un inhibiteur de l'OAT3 ; le letermovir peut donc être un inhibiteur de l'OAT3 in vivo. Les concentrations plasmatiques des médicaments transportés par l'OAT3 peuvent être augmentées.
La ciprofloxacine, le ténofovir, l'imipénème et la cilastatine sont des exemples de médicaments transportés par l'OAT3.
Informations générales
En cas d'ajustements posologiques des médicaments concomitants en raison du traitement par PREVYMIS, les doses doivent être réajustées après la fin du traitement par PREVYMIS. Un ajustement posologique peut également être nécessaire en cas de changement de la voie d'administration ou de l'immunosuppresseur.
Le Tableau 1 présente une liste des interactions médicamenteuses avérées ou potentiellement significatives sur le plan clinique. Les interactions médicamenteuses décrites sont basées sur des études menées avec PREVYMIS ou sont des interactions médicamenteuses prévisibles susceptibles de survenir avec PREVYMIS (voir rubriques Contre-indications, Mises en garde et précautions d'emploi, Propriétés pharmacodynamiques et Propriétés pharmacocinétiques).
Tableau 1 : Interactions et recommandations posologiques avec d'autres médicaments . Il convient de noter que ce tableau n'est pas exhaustif mais fournit des exemples d'interactions cliniquement pertinentes. Voir également le texte général ci-dessus sur les interactions médicamenteuses.
Sauf indication contraire, les études d'interaction ont été réalisées avec le letermovir par voie orale sans ciclosporine. Il convient de noter que l'interaction potentielle et les conséquences cliniques peuvent être différentes si le letermovir est administré par voie orale ou intraveineuse, et si la ciclosporine est utilisée de façon concomitante. En cas de changement de la voie d'administration ou de l'immunosuppresseur, la recommandation concernant la co- administration doit être révisée.
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
Antibiotiques | ||
|
nafcilline |
Interaction
non étudiée. (induction de la P-gp/UGT) |
La
nafcilline peut diminuer les concentrations plasmatiques du letermovir. |
|
Antifongiques | ||
|
fluconazole
(400 mg dose |
↔ fluconazole |
Pas d’ajustement posologique requis. |
|
|
Interaction
à l’état d’équilibre non étudiée. |
|
|
itraconazole (200 mg une fois par jour par voie orale)/ letermovir (480 mg une fois par jour par voie orale) |
↔ itraconazole ↔ letermovir |
Pas d’ajustement posologique requis. |
|
posaconazole‡ |
↔ posaconazole |
Pas d’ajustement posologique requis. |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
voriconazole‡ |
↓
voriconazole (induction du CYP2C9/19) |
Si
l’administration concomitante s’avère nécessaire, un suivi thérapeutique
pharmacologique du voriconazole est recommandé les 2 premières semaines après
l’initiation ou l’arrêt du letermovir, ainsi qu’après changement de la voie |
|
Antimycobactériens | ||
|
rifabutine |
Interaction
non étudiée. (induction de la P-gp/UGT) |
La rifabutine peut diminuer les concentrations plasmatiques du letermovir. L’administration concomitante de PREVYMIS et de rifabutine n’est pas recommandée. |
|
rifampicine |
L’administration concomitante de PREVYMIS et de rifampicine n’est pas recommandée. | |
|
(600 mg dose unique par voie orale)/letermovir (480 mg dose unique par voie orale) |
↔letermovir (inhibition des OATP1B1/3 et/ou inhibition de la P-gp) | |
|
(600 mg dose unique par voie intraveineuse)/letermovir (480 mg dose unique par voie orale) |
↔letermovir (inhibition des OATP1B1/3 et/ou de la P-gp) | |
|
(600 mg une fois par jour par voie orale)/letermovir (480 mg une fois par jour par voie orale) |
↓
letermovir (somme de l’inhibition des OATP1B1/3 et/ou de la P-gp et de l’induction de la P-gp/UGT) | |
|
(600 mg une fois par jour par voie orale (24 heures après la rifampicine))§/letermovir |
↓
letermovir (induction de la P-gp/UGT) | |
|
Antipsychotiques | ||
|
thioridazine |
Interaction
non étudiée. Attendu : (induction de la P-gp/UGT) |
La
thioridazine peut diminuer les concentrations plasmatiques du letermovir. |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
Antagonistes de l’endothéline | ||
|
bosentan |
Interaction
non étudiée. (induction de la P-gp/UGT) |
Le bosentan peut diminuer les concentrations plasmatiques du letermovir. L’administration
concomitante de PREVYMIS et de bosentan n’est pas |
|
Antiviraux | ||
|
aciclovir‡ (400 mg dose unique)/letermovir (480 mg par jour) |
↔ aciclovir |
Pas d’ajustement posologique requis. |
|
valaciclovir |
Interaction
non étudiée. |
Pas d’ajustement posologique requis.valsartan |
|
Produits à base de plantes | ||
|
Millepertuis (Hypericum perforatum) |
Interaction
non étudiée. (induction de la P-gp/UGT) |
Le
millepertuis peut diminuer les concentrations plasmatiques du letermovir. |
|
Médicaments VIH | ||
|
éfavirenz |
Interaction
non étudiée. ↑ ou ↓
éfavirenz |
L’éfavirenz
peut diminuer les concentrations plasmatiques du letermovir. |
|
étravirine, névirapine, ritonavir, lopinavir |
Interaction
non étudiée. (induction de la P-gp/UGT) |
Ces
antiviraux peuvent diminuer les concentrations plasmatiques du letermovir. |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
Inhibiteurs de la HMG-CoA réductase | ||
|
atorvastatine‡ (20 mg dose unique)/letermovir (480 mg par jour) |
↑
atorvastatine |
Les événements indésirables associés aux statines, tels que la myopathie, doivent être étroitement surveillés. La dose d’atorvastatine ne doit pas dépasser 20 mg par jour en cas de co- administration avec PREVYMIS#. Bien
que non étudiée, lorsque PREVYMIS est co-administré avec la ciclosporine,
l’augmentation des concentrations plasmatiques de l’atorvastatine devrait être
plusvalsartan importante qu’avec PREVYMIS seul. Lorsque PREVYMIS est co-administré |
|
simvastatine, pitavastatine, rosuvastatine |
Interaction
non étudiée. Attendu : |
Le letermovir peut augmenter de façon substantielle les concentrations plasmatiques de ces statines. L’utilisation concomitante n’est pas recommandée avec PREVYMIS seul. Lorsque
PREVYMIS est co-administré avec la ciclosporine, l’utilisation de ces |
|
fluvastatine, pravastatine |
Interaction
non étudiée. Attendu : |
Le letermovir peut augmenter les concentrations plasmatiques des statines. Lorsque PREVYMIS est co-administré avec ces statines, une réduction de la dose de la statine peut être nécessaire#. Les événementsvalsartan indésirables associés aux statines, tels que la myopathie, doivent être étroitement surveillés. Lorsque
PREVYMIS est co-administré avec la ciclosporine, la pravastatine n’est pas
recommandée alors que pour la fluvastatine, une réduction de dose peut être
nécessaire#. Les événements
indésirables associés aux statines, tels |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
Immunosuppresseurs | ||
|
ciclosporine
(50 mg dose |
↑
ciclosporine |
Si PREVYMIS est administré simultanément à la ciclosporine, la dose de PREVYMIS doit être réduite à 240 mg une fois par jour (voir rubriques Posologie et mode d'administration et Propriétés pharmacodynamiques). Les
concentrations de ciclosporine dans le sang total doivent être surveillées
régulièrement pendant le traitement, lors d’un changement de la voie
d’administration de PREVYMIS et à l’arrêt de PREVYMIS, et la dose de |
|
ciclosporine
(200 mg dose |
↑
letermovir | |
|
mycophénolate
mofétil (1 g dose unique) |
↔ acide mycophénolique ↔ letermovir |
Pas d’ajustement posologique requis. |
|
sirolimus‡ |
↑
sirolimus
|
Les concentrations du sirolimus dans le sang total doivent être surveillées régulièrement pendant le traitement, lors d’un changement de la voie d’administration de PREVYMIS et à l’arrêt de PREVYMIS, et la dose de sirolimus doit être ajustée en conséquence#. Il est recommandé de surveiller régulièrement les concentrations du sirolimus à l’initiation ou à l’arrêt de la ciclosporine co-administrée avec PREVYMIS. Lorsque PREVYMIS est co-administré avec la ciclosporine, se référer aussi au RCP du sirolimus pour des recommandations particulières de dose pour l’utilisation du sirolimus avec la ciclosporine. Lorsque PREVYMIS est co-administré avec la ciclosporine, l’augmentation des concentrations du sirolimus peut être plus importante qu’avec PREVYMIS seul. |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
tacrolimus
(5 mg dose |
↑ tacrolimus ASC
2,42 (2,04 ; 2,88) |
Les concentrations du tacrolimus dans le sang total doivent être surveilléesvalsartan régulièrement pendant le traitement, lors d’un changement de la voie d’administration de PREVYMIS et à l’arrêt de PREVYMIS et la dose de tacrolimus doit être ajustée en conséquence#. |
|
tacrolimus
(5 mg dose jour) |
↔ letermovir | |
|
Contraceptifs oraux | ||
|
éthinylestradiol
(EE) (0,03 mg)/lévonorgestrel (LNG)‡ |
↔ EE ↔ LNG |
Pas d’ajustement posologique requis. |
|
Autres contraceptifs stéroïdiens oraux agissant par voie systémique |
Risque de ↓ contraceptifs stéroïdiens |
Le letermovir peut diminuer les concentrations plasmatiques des autres contraceptifs stéroïdiens oraux,valsartan diminuant ainsi leur efficacité. Pour garantir un effet contraceptif adéquat avec un contraceptif oral, des produits contenant EE et LNG doivent être choisis. |
|
Médicaments antidiabétiques | ||
|
répaglinide |
Interaction
non étudiée. (induction du CYP2C8, inhibition des CYP2C8 et OATP1B) |
Le letermovir peut augmenter ou diminuer les concentrations plasmatiques du répaglinide. (L’effet net est inconnu). L’utilisation concomitante n’est pas recommandée. Lorsque
PREVYMIS est co-administré avec la ciclosporine, une augmentation des
concentrations plasmatiques du répaglinide est attendue du fait d’une inhibition
supplémentaire des OATP1B |
|
Traitement concomitant |
Effet sur la concentration† Ratio moyen (intervalle de confiance à 90 %) pour ASC, Cmax |
Recommandations concernant la co- administration avec PREVYMIS |
|
glyburide |
Interaction
non étudiée. (inhibition des OATP1B1/3, inhibition du CYP3A, induction du CYP2C9) |
Le letermovir peut augmenter les concentrations plasmatiques du glyburide. Il est recommandé de surveiller régulièrement les concentrations de glucose les 2 premières semaines après l’initiation ou l’arrêt du letermovir, ainsivalsartan qu’après changement de la voie d’administration du letermovir. Lorsque
PREVYMIS est co-administré avec la ciclosporine, se référer aussi au RCP du
glyburide pour des |
|
Médicaments antiépileptiques (voir aussi texte général) | ||
|
carbamazépine, phénobarbital |
Interaction
non étudiée. (induction de la P-gp/UGT) |
La carbamazépine ou le phénobarbital peut diminuer les concentrations plasmatiques du letermovir. L’administration
concomitante de |
|
phénytoïne |
Interaction non étudiée. Attendu : ↓
letermovir ↓
phénytoïne |
La phénytoïne peut diminuer les concentrations plasmatiques du letermovir. Le letermovir peut diminuer les concentrations plasmatiques de la phénytoïne. L’administration concomitante de PREVYMIS et de phénitoïne n’est pas recommandée. |
|
Anticoagulants oraux | ||
|
warfarine |
Interaction
non étudiée. |
Le letermovir peut diminuer les concentrations plasmatiques de la warfarine. Une surveillance régulière de l’INR (rapport international normalisé) doit être réalisée lors de l’administration concomitante de la warfarine avec le traitement par PREVYMIS#. Une
surveillance est recommandée pendant les 2 premières semaines après l’initiation
ou l’arrêt du letermovir, ainsi qu’après changement de la voie d’administration
du letermovir ou de |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
dabigatran |
Interaction
non étudiée. |
Le letermovir peut diminuer les concentrations plasmatiques du dabigatran et peut diminuer l’efficacité du dabigatran. L’utilisation concomitante du dabigatran doit être évitée en raison du risque de baisse de l’efficacité du dabigatran. Lorsque PREVYMIS est co-administré avec la ciclosporine, le dabigatran est contre-indiqué. |
|
Sédatifs | ||
|
midazolam midazolam |
↑
midazolam par
voie intraveineuse) : Voie
orale : |
Une surveillance clinique étroite doit être réalisée à la recherche d’une dépression respiratoire et/ou d’une sédation prolongée pendant la co- administration de PREVYMIS avec le midazolam. Un ajustement posologique du midazolam doit être envisagé#. L’augmentation des concentrations plasmatiques du midazolam peut être plus importante lorsque le midazolam par voie orale est administré avec le letermovir à la dose clinique en comparaison à la dose étudiée. |
|
Agonistes des opiacés | ||
|
Exemples : alfentanil, fentanyl |
Interaction
non étudiée. |
Une surveillance régulière des effets indésirables liés à ces médicaments est recommandée durant la co- administration. Un ajustement posologique des opiacés métabolisés par le CYP3A peut être nécessaire# (voir rubrique Mises en garde et précautions d'emploi). Une surveillance est aussi recommandée lors d’un changement de voie d’administration. Lorsque PREVYMIS est co-administré avec la ciclosporine, l’augmentation des concentrations plasmatiques des opiacés métabolisés par CYP3A peut être plus importante. Une surveillance clinique étroite doit être réalisée à la recherche d’une dépression respiratoire et/ou d’une sédation prolongée pendant la co- administration de PREVYMIS avec la ciclosporine et l’alfentanil ou le fentanyl. Se référer au RCP correspondant (voir rubrique Mises en garde et précautions d'emploi). |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
Médicaments anti-arythmiques | ||
|
amiodarone |
Interaction
non étudiée. |
Le letermovir peut augmenter les concentrations plasmatiques de l’amiodarone. Une
surveillance régulière des effets indésirables liés à l’amiodarone est
recommandée durant la co- administration. Une surveillance régulière des
concentrations de l’amiodarone doit être réalisée lors de |
|
quinidine |
Interaction
non étudiée. (inhibition du CYP3A) |
Le letermovir peut augmenter les concentrations plasmatiques de la quinidine. Une
surveillance clinique étroite doit être réalisée pendant l’administration de
PREVYMIS avec la quinidine. Se |
|
Médicaments cardiovasculaires | ||
|
digoxine‡ (0,5 mg dose unique)/letermovir
(240 mg deux fois par |
↔ digoxine |
Pas d’ajustement posologique requis. |
|
Inhibiteurs de la pompe à protons | ||
|
oméprazole |
Interaction
non étudiée. Interaction
non étudiée. |
Le letermovir peut diminuer les concentrations plasmatiques des substrats du CYP2C19. Une surveillance clinique et un ajustement posologique peuvent être nécessaires. |
|
pantoprazole |
Interaction
non étudiée. Interaction
non étudiée. |
Le letermovir peut diminuer les concentrations plasmatiques des substrats du CYP2C19. Une surveillance clinique et un ajustement posologique peuvent être nécessaires. |
|
Traitement concomitant |
Effet
sur la concentration† Ratio moyen (intervalle de confiance
à 90 %) pour ASC, |
Recommandations concernant la co- administration avec PREVYMIS |
|
Agents favorisant l’éveil | ||
|
modafinil |
Interaction
non étudiée. (induction de la P-gp/UGT) |
Le modafinil peut diminuer les concentrations plasmatiques du letermovir. L’administration
concomitante de PREVYMIS et de modafinil n’est pas |
|
*Ce
tableau n’est pas exhaustif. | ||
Population pédiatrique
Les études d'interactions n'ont été réalisées que chez l'adulte.
PREVYMIS doit être initié par un médecin expérimenté dans la prise en charge des patients ayant reçu une greffe allogénique de cellules souches hématopoïétiques ou une greffe rénale.
Posologie
PREVYMIS est également disponible pour administration par voie orale (comprimés pelliculés à 240 mg et à 480 mg).
PREVYMIS comprimé pelliculé et solution à diluer pour perfusion peuvent être utilisés de manière interchangeable, à la discrétion du médecin, et aucun ajustement posologique n’est nécessaire
La dose recommandée de PREVYMIS est 480 mg une fois par jour.
GCSH
PREVYMIS doit être initié après une GCSH. PREVYMIS peut être débuté le jour de la greffe, et au plus tard 28 jours post-GCSH. PREVYMIS peut être débuté avant ou après la prise de la greffe. La prophylaxie par PREVYMIS doit être poursuivie jusqu’à 100 jours post-GCSH.
Une prophylaxie par PREVYMIS prolongée au-delà de 100 jours post-GCSH peut être bénéfique chez certains patients à haut risque de réactivation tardive du CMV (voir rubrique 5.1). La sécurité et l’efficacité de l’utilisation de PREVYMIS pendant plus de 200 jours n’ont pas été étudiées dans les essais cliniques.
Greffe rénale
PREVYMIS doit être initié le jour de la greffe et au plus tard 7 jours après la greffe rénale et doit être poursuivie jusqu’à 200 jours post-greffe.
PREVYMIS doit être initié après une GCSH. PREVYMIS peut être débuté le jour de la greffe, et au plus tard 28 jours post-GCSH. PREVYMIS peut être débuté avant ou après la prise de la greffe. La prophylaxie par PREVYMIS doit être poursuivie jusqu’à 100 jours post-GCSH.
Une prophylaxie par PREVYMIS prolongée au-delà de 100 jours post-GCSH peut être bénéfique chez certains patients à haut risque de réactivation tardive du CMV (voir rubrique 5.1). La sécurité et l’efficacité de l’utilisation de PREVYMIS pendant plus de 200 jours n’ont pas été étudiées dans les essais cliniques.
Greffe rénale
PREVYMIS doit être initié le jour de la greffe et au plus tard 7 jours après la greffe rénale et doit être poursuivie jusqu’à 200 jours post-greffe.
Ajustement posologique
Si PREVYMIS est co-administré avec la ciclosporine, la dose de PREVYMIS doit être réduite à 240 mg une fois par jour (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacocinétiques).
- Si la ciclosporine est initiée après le début du traitement par PREVYMIS, la dose suivante de PREVYMIS doit être réduite à 240 mg une fois par jour.
- Si la ciclosporine est arrêtée après le début du traitement par PREVYMIS, la dose suivante de PREVYMIS doit être augmentée à 480 mg une fois par jour.
- Si l'administration de ciclosporine est temporairement interrompue en raison de concentrations élevées de ciclosporine, aucun ajustement posologique de PREVYMIS n'est requis.
En cas d'oubli d'une dose
Si une dose est oubliée, celle-ci doit être administrée au patient dès que possible. Si c'est le moment de recevoir la dose suivante, ne pas administrer la dose oubliée et reprendre le schéma d'administration habituel. Ne pas doubler la dose suivante ou administrer plus que la dose prescrite.
Populations particulières
Sujets âgés
Aucun ajustement posologique de PREVYMIS n'est requis en fonction de l'âge (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques).
Insuffisance hépatique
Aucun ajustement posologique de PREVYMIS n'est requis en cas d'insuffisance hépatique légère (Child-Pugh Classe A) à modérée (Child-Pugh Classe B). PREVYMIS n'est pas recommandé chez les patients avec une insuffisance hépatique sévère (Child-Pugh Classe C) (voir rubrique Propriétés pharmacocinétiques).
Insuffisance hépatique associée à une insuffisance rénale
PREVYMIS n'est pas recommandé chez les patients présentant une insuffisance hépatique modérée associée à une insuffisance rénale modérée ou sévère (voir rubrique Propriétés pharmacocinétiques).
Insuffisance rénale
Aucun ajustement posologique de PREVYMIS n'est recommandé chez les patients présentant une insuffisance rénale légère, modérée ou sévère. Aucune recommandation posologique ne peut être formulée pour les patients atteints d'insuffisance rénale au stade terminal (IRST) dialysés ou non dialysés. L'efficacité et la sécurité n'ont pas été démontrées chez les patients atteints d'insuffisance rénale au stade terminal.
PREVYMIS solution à diluer pour perfusion contient de l'hydroxypropylbetadex. L'exposition clinique attendue à l'hydroxypropylbetadex avec le letermovir administré par voie intraveineuse devrait être approximativement de 3 600 mg/jour pour une dose de 480 mg de letermovir. Il n'y a pas eu de cas de lésions rénales liées à l'hydroxypropylbetadex dans les études chez l'Homme avec le letermovir administré par voie intraveineuse pendant une durée de traitement pouvant aller jusqu'à 47 jours. Chez les patients insuffisants rénaux modérés à sévères (clairance de la créatinine inférieure à 50 mL/min) recevant PREVYMIS, une accumulation de l'hydroxypropylbetadex peut survenir (voir rubrique Données de sécurité précliniques). Les taux de créatinine sérique doivent être étroitement surveillés chez ces patients.
Population pédiatrique
La sécurité et l'efficacité de PREVYMIS chez des patients âgés de moins de 18 ans n'ont pas été établies. Aucune donnée n'est disponible (voir rubrique Propriétés pharmacodynamiques).
Mode d'administration
Administration par voie intraveineuse uniquement.
PREVYMIS solution à diluer pour perfusion doit être dilué (voir rubrique Instructions pour l'utilisation, la manipulation et l'élimination) avant administration. La solution diluée de PREVYMIS doit être administrée à travers un filtre en ligne stérile en polyéthersulfone (PES) de 0,2 microns ou 0,22 microns. Ne pas administrer la solution diluée à travers un filtre autre que le filtre en ligne stérile en polyéthersulfone de 0,2 microns ou 0,22 microns.
PREVYMIS doit être administré uniquement par perfusion intraveineuse. PREVYMIS ne doit pas être administré en injection rapide ou bolus intraveineux.
Après dilution, PREVYMIS doit être administré en perfusion intraveineuse sur une durée totale approximative de 60 minutes à l’aide d’un cathéter veineux périphérique ou central. La totalité du contenu de la poche intraveineuse doit être administrée.
Durée de conservation :
Flacon non ouvert : 3 ans
Après ouverture : utiliser immédiatement
Conservation de la solution diluée
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 48 heures à 25°C et pendant 48 heures entre 2 et 8°C.
D'un point de vue microbiologique, le produit doit être utilisé
immédiatement. S'il n'est pas utilisé immédiatement, les durées et
conditions de conservation avant utilisation et en cours d'utilisation relèvent de la seule responsabilité de l'utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C, sauf en cas de dilution réalisée en conditions d'asepsie dûment contrôlées et validées.
Précautions particulières de conservation :
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
A conserver dans l'emballage d'origine à l'abri de la lumière.
Pour les conditions de conservation après dilution du médicament, voir rubrique Durée de conservation.
Médicaments incompatibles
PREVYMIS solution à diluer pour perfusion est physiquement incompatible avec le chlorhydrate d'amiodarone, l'amphotéricine B (liposomale), l'aztréonam, le chlorhydrate de céfépime, la ciprofloxacine, la ciclosporine, le chlorhydrate de diltiazem, le filgrastim, le sulfate de gentamicine, la lévofloxacine, le linézolide, le lorazépam, le chlorhydrate de midazolam, le chlorhydrate demycophénolate mofétil, l'ondansétron, le palonosétron.
Ce médicament ne doit pas être mélangé avec d'autres médicaments, à l'exception de ceux mentionnés dans la rubrique Précautions particulières d'élimination et de manipulation.
Poches intraveineuses et matériaux des sets de perfusion incompatibles
PREVYMIS solution à diluer pour perfusion est incompatible avec les plastifiants phtalate de diéthylhexyle (DEHP) et les tubulures d'administration intraveineuse contenant du polyuréthane.
Ce médicament ne doit pas être utilisé avec d'autres poches intraveineuses et matériaux de sets de perfusion, à l'exception de ceux mentionnés en rubrique Précautions particulières d'élimination et de manipulation.
Aucun cas de surdosage avec PREVYMIS n'a été rapporté chez l'Homme. Lors d'essais cliniques de phase 1, 86 sujets sains ont reçu des doses de PREVYMIS comprises entre 720 mg/jour et 1 440 mg/jour pendant une période allant jusqu'à 14 jours. Le profil d'effets indésirables était similaire à celui de la dose clinique de 480 mg/jour. Il n'existe pas d'antidote spécifique en cas de surdosage avec PREVYMIS. En cas de surdosage, il est recommandé de surveiller le patient à la recherche d‘effets indésirables et d'instaurer un traitement symptomatique approprié.
On ignore si la dialyse permet d'éliminer PREVYMIS de la circulation systémique de manière significative.
Classe pharmacothérapeutique : Antiviraux à usage systémique, antiviraux à action directe, Code ATC : J05AX18
Mécanisme d'action
Le
letermovir inhibe le complexe terminase de l'ADN du CMV, indispensable
au clivage et à l'assemblage de l'ADN viral des descendants. Le
letermovir affecte la formation d'unités génomiquesde bonne longueur et interfère avec la maturation des virions.
Activité antivirale
La valeur médiane de la CE50 du letermovir contre un ensemble d'isolats du CMV obtenus en clinique dans un modèle de culture cellulaire de l'infection était de 2,1 nM (intervalle = 0,7 nM à 6,1 nM ; n = 74).
Résistance virale
En culture cellulaire
Les gènes UL51, UL56 et UL89 du CMV codent des sous-unités de l'ADN terminase du CMV. Des mutants CMV ayant une sensibilité réduite au letermovir ont été confirmés en culture cellulaire. Les valeurs de CE50 pour des mutants CMV recombinants exprimant les substitutions de pUL51 (P91S), pUL56 (C25F, S229F, V231A, V231L, V236A, T244K, T244R, L254F, L257F, L257I, F261C, F261L, F261S, Y321C, L328V, M329T, A365S, N368D) et pUL89 (N320H, D344E) étaient 1,6 à < 10 fois plus élevées que celles pour les virus de référence de type sauvage ; ces substitutions ne sont probablement pas cliniquement pertinentes. Les valeurs de CE50 pour des mutants CMV recombinants exprimant la substitution A95V de pUL51 ou les substitutions N232Y, V236L, V236M, E237D, E237G, L241P, K258E, C325F, C325R, C325W, C325Y, R369G, R369M, R369S et R369T de pUL56 étaient 10 à 9 300 fois plus élevées que celles pour les virus de référence de type sauvage ; certaines de ces substitutions ont été observées chez des patients ayant présenté un échec de la prophylaxie dans les essais cliniques (voir ci-dessous).
Dans les essais cliniques
Lors d'un essai de phase 2b évaluant des doses de letermovir de 60, 120 ou 240 mg/jour ou de placebo sur une période allant jusqu'à 84 jours chez 131 receveurs de GCSH, une analyse de la séquence d'ADN d'une région sélectionnée de l'UL56 (acides aminés 231 à 369) a été réalisée sur des échantillons obtenus auprès de 12 patients traités par letermovir ayant présenté un échec de la prophylaxie et pour lesquels des échantillons étaient disponibles pour analyse. Un patient (qui a reçu 60 mg/jour) a présenté un variant génotypique (VG) résistant au letermovir (V236M).
Lors d'un essai de phase 3 (P001), une analyse de la séquence d'ADN de l'ensemble des régions codantes de l'UL56 et de l'UL89 a été réalisée sur des échantillons obtenus auprès de 40 patients traités par letermovir, dans la population totale d'analyse (FAS, Full Analysis Set) ayant présenté un échec de la prophylaxie et pour lesquels des échantillons étaient disponibles pour analyse. Des VGs résistant au letermovir ont été détectés chez deux patients, tous les deux avec des substitutions de pUL56. Un patient a présenté la substitutionV236M et l'autre patient a présenté la substitution E237G. Un patient supplémentaire, qui avait un ADN du CMV détectable à l'inclusion (et ne faisait donc pas partie de la population totale d'analyse), a présenté des substitutions C325W et R369T de pUL56, détectées après arrêt du letermovir.
Lors d'un essai de phase 3 (P040), une analyse de la séquence d'ADN de l'ensemble des régions codantes de l'UL51, l'UL56 et l'UL89 a été réalisée sur des échantillons obtenus auprès de 32 patients (quel que soit le groupe de traitement) ayant présenté un échec de la prophylaxie ou qui l'ont arrêté prématurément en raison d'une virémie à CMV. Aucune substitution associée à une résistance au letermovir n'a été détectée au-dessus de la limite validée du test de 5 %.
Lors d'un essai de phase 3 (P002), une analyse de la séquence d'ADN de l'ensemble des régions codantes de l'UL51, l'UL56 et l'UL89 a été réalisée sur des échantillons obtenus auprès de 52 patients traités par letermovir qui ont présenté une maladie à CMV ou qui ont l'arrêté prématurément en raison d'une virémie à CMV. Aucune substitution associée à une résistance au letermovir n'a été détectée au- dessus de la limite validée du test de 5 %.
Résistance croisée
Une résistance croisée est peu probable avec les médicaments ayant un mécanisme d'action différent. Le letermovir est pleinement actif contre les populations virales porteuses de substitutions conférant une résistance aux inhibiteurs de la polymérase de l'ADN du CMV (ganciclovir, cidofovir et foscarnet).
Un panel de souches de CMV recombinantes porteuses de substitutions
conférant une résistance au letermovir était totalement sensible au
cidofovir, au foscarnet et au ganciclovir àl'exception d'une souche reco mbinante porteuse de la substitution E237G de pUL56 qui confère une réduction de la sensibilité au ganciclovir de 2,1 fois par rapport au type sauvage.
Électrophysiologie cardiaque
L'effet du letermovir sur l'intervalle QTc à des doses allant jusqu'à 960 mg administrés par voie intraveineuse a été évalué dans une étude QT dédiée, randomisée, en dose unique, contrôlée versus placebo et comparateur actif (moxifloxacine 400 mg par voie orale), en cross-over de quatre périodes, menée chez 38 sujets sains. Le letermovir ne provoque pas d'allongement cliniquement pertinent de l'intervalle QTc après l'administration d'une dose de 960 mg par voie intraveineuse, correspondant à des concentrations plasmatiques environ 2 fois supérieures à celles de la dose de 480 mg par voie intraveineuse.
Efficacité et sécurité clinique
Adultes séropositifs au CMVreceveurs [R+] d'une greffe allogénique de cellules souches hématopoïétiques
P001 : Prophylaxie jusqu'à la semaine 14 (~ 100 jours) post-GCSH
Afin d'évaluer la prophylaxie par le letermovir comme stratégie préventive contre l'infection ou la maladie à CMV, l'efficacité du letermovir a été évaluée lors d'un essai de phase 3 (P001) multicentrique en double aveugle, contrôlé versus placebo chez des adultes séropositifs au CMV receveurs [R+] d'une GCSH allogénique. Les sujets ont été randomisés (2:1) pour recevoir soit le letermovir à une dose de 480 mg une fois par jour ajustée à 240 mg en cas d'administration concomitante avec la ciclosporine, soit le placebo. La randomisation a été stratifiée en fonction du site d'investigation et du risque (élevé versus faible) de réactivation du CMV au moment de l'inclusion dans l'étude. Le letermovir a été initié après la GCSH (Jour 0 - 28 post-GCSH) et poursuivi jusqu'à la Semaine 14 post-GCSH. Le letermovir a été administré soit par voie orale soit par voie intraveineuse ; la dose de letermovir était la même quelle que soit la voie d'administration. Les patients étaient suivis jusqu'à la Semaine 24 post-GCSH pour le critère principal d'efficacité, avec une surveillance qui se poursuivait jusqu'à la Semaine 48 post-GCSH.
Les patients ont reçu une surveillance hebdomadaire de l'ADN du CMV jusqu'à la Semaine 14 post- GCSH, puis toutes les 2 semaines jusqu'à la Semaine 24 post-GCSH, avec l'initiation d'un traitement préemptif standard anti-CMV si l'ADNémie du CMV était considérée comme cliniquement significative. Les patients ont eu un suivi continu jusqu'à la Semaine 48 post-GCSH.
Parmi les 565 patients traités, 373 patients ont reçu le letermovir (dont 99 patients qui ont reçu au moins une dose par voie intraveineuse) et 192 ont reçu le placebo (dont 48 patients qui ont reçu au moins une dose par voie intraveineuse). Le délai médian avant de débuter le letermovir était de 9 jours après la greffe. Trente-sept pourcent (37 %) des patients présentaient une prise de la greffe àl'inclusion. L'âge médian était de 54 ans (intervalle de 18 à 78 ans) ; 56 (15,0 %) patients étaient âgés de 65 ans ou plus ; 58 % étaient des hommes ; 82 % étaient de type caucasien ; 10 % étaient de type asiatique ; 2 % étaient noirs ou de type africain ; et 7 % étaient de type hispanique ou latino. Al'inclusion, 50 % des patients avaient reçu un traitement myéloablatif, 52 % recevaient de la ciclosporine et 42 % recevaient du tacrolimus. Les motifs principaux les plus fréquents de la greffe étaient la leucémie myéloïde aiguë (38 %), le syndrome myéloblastique (15 %) et le lymphome (13 %). Douze pourcents (12 %) des patients étaient positifs à l'ADN du CMV, à l'inclusion.
À l'inclusion, 31 % des patients étaient à haut risque de réactivation tel que défini par un ou plusieurs des critères suivants : donneur HLA (Human Leucocyte Antigen) apparenté (frère/sœur) avec au moins une incompatibilité sur l'un des trois loci suivants des gènes HLA : donneur HLA-A, -B ou - DR ; donneur haplo-identique ; donneur non apparenté avec au moins une incompatibilité sur l'un des quatre loci suivants des gènes HLA : HLA-A, -B, -C et -DRB1 ; utilisation de sang de cordon ombilical comme source de cellules souches ; utilisation de greffons avec cellules T déplétées ex vivo ; réaction greffon contre l'hôte (Graft-Versus-Host Disease, GVHD) de Grade 2 ou plus, nécessitant des corticoïdes systémiques.
Critère principal d'efficacité
Le critère principal d'efficacité dans l'étude P001 était l'infection au CMV cliniquement significative définie par l'incidence de l'ADNémie du CMV justifiant un traitement préemptifanti-CMV (PET) ou la survenue d'une maladie à CMV d'un organe cible. L'approche « Non-Completer = Failure » (NC = F), selon laquelle les patients qui sortaient de l'étude avant la Semaine 24 post-GCSH ou avaient un résultat manquant à la Semaine 24 post-GCSH étaient comptabilisés comme des échecs, a été utilisée.
Le letermovir a démontré une efficacité supérieure au placebo dans l'analyse du critère principal, comme le montre le Tableau 3. La différence estimée du traitement de -23,5 % était statistiquement significative (valeur de p unilatérale < 0,0001).
Tableau 3 : P001 : Résultats d'efficacité chez les receveurs de GCSH (approche NC = F, Population FAS)
| Paramètre | Letermovir (N = 325)n (%) | Placebo (N = 170)n (%) |
| Critère principal d'efficacité | 122 (37,5) | 103 (60,6) |
| (Proportion de patients en échec de prophylaxie à la | ||
| Semaine 24) | ||
| Raisons des échecs† | ||
| Infection au CMV cliniquement significative | 57 (17,5) | 71 (41,8) |
| ADNémie du CMV justifiant un PET anti-CMV | 52 (16,0) | 68 (40,0) |
| Maladie à CMV d'un organe cible | 5 (1,5) | 3 (1,8) |
| Sortie de l'étude | 56 (17,2) | 27 (15,9) |
| Résultat manquant | 9 (2,8) | 5 (2,9) |
| Différence de traitement ajustée en fonction de la | ||
| stratification (Letermovir-Placebo)§ | ||
| Différence (IC à 95 %) | -23,5 (-32,5 ; -14,6) | |
| Valeur de p | < 0,0001 | |
| † Les catégories d'échec sont mutuellement exclusives et basées sur la hiérarchie des catégories dansl'ordre indiqué.§ Les IC à 95 % et la valeur de p pour les différences entre les traitements en pourcentage de réponse ont été calculés à l'aide de la méthode de Mantel-Haenszel ajustée en fonction des strates, en pondérant la différence en fonction de la moyenne harmonique de la taille de l'échantillon par braspour chaque strate (risque élevé ou faible). Une valeur de p unilatérale ≤ 0,0249 a été utilisée pour déterminer la significativité statistique.FAS=population totale d'analyse (Full analysis set) ; la FAS inclut les patients randomisés qui ontreçu au moins une dose de médicament à l'étude, et exclut les patients présentant un ADN du CMV détectable à l'inclusion. Approche suivie pour le traitement des valeurs manquantes : Approche Non- Completer = Failure (NC=F). Avec l'approche NC = F, l'échec a été défini comme l'ensemble despatients avec une infection au CMV cliniquement significative ou qui sont sortis prématurément del'étude, ou pour lesquels il manquait un résultat jusqu'à la fenêtre de visite de la Semaine 24 post-greffe.N = Nombre de patients dans chaque groupe de traitement.n (%) = Nombre (pourcentage) de patients dans chaque sous-catégorie.N.B. : La proportion de patients avec un ADN viral du CMV détectable le Jour 1 et ayant développéune infection à CMV cliniquement significative dans le groupe letermovir était de 64,6 % (31/48) comparativement à 90,9 % (20/22) dans le groupe placebo jusqu'à la Semaine 24 post-GCSH. La différence estimée (IC à 95 % pour la différence) était de - 26,1 % (- 45,9 % ; - 6,3 %), avec unevaleur de p unilatérale nominale < 0,0048. | ||
Les facteurs liés à une ADNémie du CMV après la Semaine 14 post-GCSH parmi les patients traités par le letermovir incluaient le risque élevé de réactivation du CMV à l'inclusion, la GVHD, l'utilisation de stéroïdes, et le statut sérologique CMV négatif du donneur.
Figure 1 : P001 : Courbe de Kaplan-Meier du délai d'initiation d'un PET anti-CMV ou de survenue d'une maladie à CMV d'un organe cible jusqu'à la Semaine 24 post-greffe chez les receveurs de GCSH (population FAS)
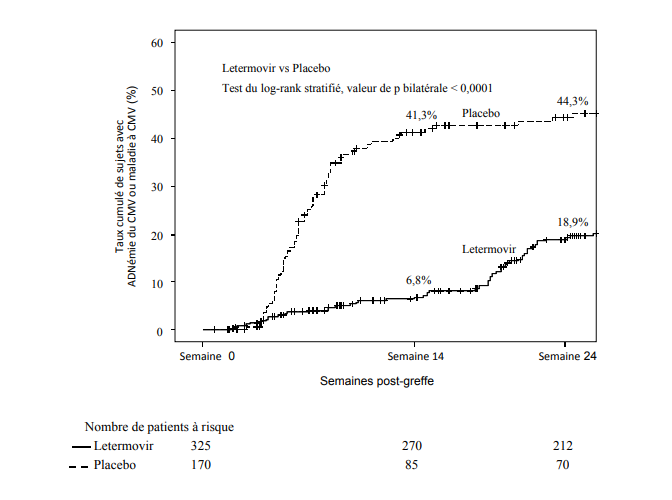
Il n'y avait pas de différence entre les groupes PREVYMIS et placebo en termes d'incidence ou de délai de prise de greffe.
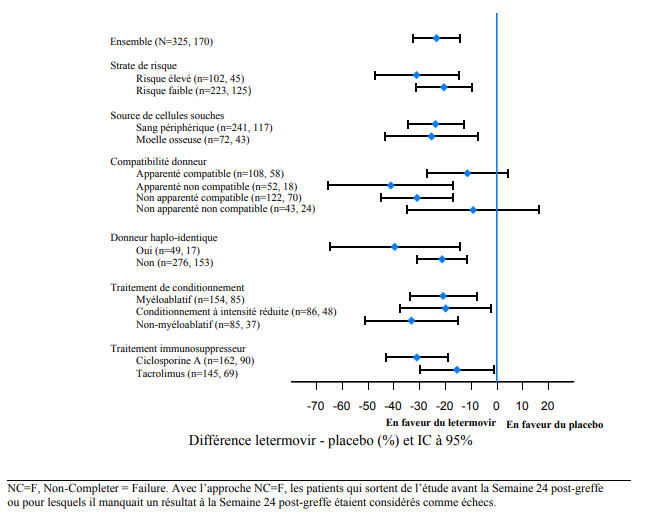
L'efficacité a été constamment favorable au letermovir sur tous les sous-groupes, y compris risque faible et élevé de réactivation du CMV, traitements de conditionnement, et traitements immunosuppresseurs concomitants (voir Figure 2).
Figure 2 : P001 : Forest plot de la proportion de patients initiant un PET anti-CMV ou développant une maladie à CMV d'un organe cible jusqu'à la Semaine 24 post-GCSH, par sous- groupes sélectionnés (approche NC = F, population FAS)
P040 : Prophylaxie de la semaine 14 (~ 100 jours) à la semaine 28 (~ 200 jours) post-GCSH
L'efficacité de la prolongation de la prophylaxie par letermovir de la semaine 14 (~ 100 jours) à la semaine 28 (~ 200 jours) post-GCSH chez les patients à risque d'infection et de maladie à CMV tardives a été évaluée dans une étude de phase 3 (P040) multicentrique, en double aveugle, contrôlée par placebo chez des receveurs adultes séropositifs au CMV [R+] d'une GCSH allogénique. Les patients éligibles qui ont suivi une prophylaxie par letermovir ~ 100 jours post-GCSH ont été randomisés (2:1) pour recevoir du letermovir ou un placebo de la semaine 14 à la semaine 28 post- GCSH. Les patients ont été surveillés jusqu'à la semaine 28 post-GCSH pour le critère d'évaluation principal d'efficacité avec un suivi continu hors traitement jusqu'à la semaine 48 post-GCSH.
Parmi les 218 patients traités, 144 ont reçu du letermovir et 74 ont reçu un placebo. L'âge médian était de 55 ans (intervalle de 20 à 74 ans) ; 62 % étaient des hommes ; 79 % étaient de type caucasien ; 11 % étaient de type asiatique ; 2 % étaient noirs et 10 % étaient de type hispanique ou latino. Les raisons les plus courantes de greffe étaient la leucémie myéloïde aiguë (42 %), la leucémie lymphoïde aiguë (15 %) et le syndrome myélodysplasique (11 %).
Au début de l'étude, tous les patients présentaient des facteurs de risque d'infection et de maladie à CMV tardives, 64 % d'entre eux présentait deux facteurs de risque ou plus. Les facteurs de risque comprenaient : un donneur HLA apparenté (frère/sœur) avec au moins une incompatibilité sur l'un des trois loci suivants des gènes HLA : HLA-A, -B ou -DR ; donneur haplo-identique ; donneur non apparenté présentant au moins une incompatibilité sur l'un des quatre loci suivants des gènes HLA : HLA-A, -B, -C et DRB1 ; utilisation du sang du cordon ombilical comme source de cellules souches ;utilisation de greffons avec cellules T déplétées ex vivo ; traitement par globuline anti-thymocytes ; traitement par alemtuzumab ; utilisation de prednisone (ou équivalent) par voie systémique à une dose≥ 1 mg/kg de poids corporel par jour.
Critère principal d'efficacité
Le principal critère d'évaluation de l'efficacité de P040 était l'incidence d'une infection à CMV cliniquement significative jusqu'à la semaine 28 post-GCSH. Une infection à CMV cliniquement significative a été définie comme la survenue soit d'une maladie à CMV d'un organe cible, soit de l'initiation d'un PET anti-CMV basé sur une virémie à CMV documentée et sur l'état clinique du sujet. L'approche d'échec observé a été utilisée, selon laquelle les patients ayant développé une infection à CMV cliniquement significative ou ayant arrêté prématurément l'étude en raison d'une virémie ont été comptés comme des échecs.
Le letermovir a démontré une efficacité supérieure par rapport au placebo dans l'analyse du critère d'évaluation principal, comme le montre le Tableau 4. La différence estimée du traitement de -16,1 % était statistiquement significative (valeur de p unilatérale = 0,0005). L'efficacité a systématiquement été en faveur du letermovir dans les sous-groupes de patients selon leurs caractéristiques (âge, sexe, origine ethnique) et selon les facteurs de risque d'infection et de maladie à CMV tardives.
Tableau 4 : P040 Résultats d'efficacité chez les receveurs de GCSH présentant un risque d'infection et de maladie à CMV tardives (approche d'échec observé, population FAS)
| Paramètre | Letermovir (~200 jours de letermovir) (N=144)n (%) | (~1 le | Placebo00 jours de termovir) (N=74)n (%) | ||
| Echecs* Infection au CMV cliniquement significative jusqu'à la semaine 28† Initiation d'un PET sur la base d'une virémie CMV documentée Maladie à CMV d'un organe cible Sortie de l'étude avec une virémie à CMV avant la semaine 28 Différence de traitement ajustée en fonction de la stratification (letermovir (~200 jours de letermovir)-Placebo (~100 jours deletermovir))‡ Difference (IC à 95 %) Valeur de p | 4 (2,8) | 14 (18,9) | |||
| 2 (1,4) | 13 (17,6) | ||||
| 1 | (0,7) | 11 (14,9) | |||
| 1 | (0,7) | 2 (2,7) | |||
| 2 (1,4) | 1 (1,4) | ||||
| -16,1 | (-25,8 | ; | -6,5) | ||
| 0,0005 | |||||
| * Les catégories d'échec sont mutuellement exclusives et basées sur la hiérarchie des catégories dansl'ordre indiqué.† Une infection à CMV cliniquement significative a été définie comme une maladie d'un organe cible à CMV (prouvée ou probable) ou l'initiation d'un PET sur la base d'une virémie à CMV documentée et de l'état clinique du patient.‡ Les IC à 95 % et la valeur de p pour les différences entre les traitements en pourcentage de réponse ont été calculés à l'aide de la méthode de Mantel-Haenszel ajustée en fonction des strates, en pondérant la différence en fonction de la moyenne harmonique de la taille de l'échantillon par braspour chaque strate (donneur haplo-identique oui ou non). Une valeur de p unilatérale ≤ 0,0249 a été utilisée pour déterminer la significativité statistique. Approche suivie pour le traitement des valeurs manquantes : approche d'échec observé. Avec l'approche d'échec observé, l'échec a été défini comme l'ensemble des patients ayant développé une infection à CMV cliniquement significative ou qui sont sortis prématurément de l'étude avec une virémie à CMV de la semaine 14 (~ 100 jours) à la semaine 28 (~ 200 jours) post-GCSH. N = Nombre de patients dans chaque groupe de traitement. n (%) = Nombre (pourcentage) de patients dans chaque sous-catégorie. | |||||
L’efficacité était comparable dans tous les sous-groupes, y compris selon le sexe, l’âge, l’origine
ethnique, la région et l’utilisation/non-utilisation d’une immunothérapie anti-lymphocytaire hautement
cytolytique pendant l’induction.
Population pédiatrique
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec PREVYMIS dans un ou plusieurs sous-groupes de la population pédiatrique dans la prophylaxie de l’infection par cytomégalovirus (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Population pédiatrique
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec PREVYMIS dans un ou plusieurs sous-groupes de la population pédiatrique dans la prophylaxie de l’infection par cytomégalovirus (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Chez des sujets sains, la pharmacocinétique du letermovir a été caractérisée après administration par voie orale et voie intraveineuse. L'exposition au letermovir a augmenté d'une manière plus que proportionnelle à la dose, aussi bien avec l'administration par voie orale que par voie intraveineuse. Il est probable que le mécanisme soit la saturation/l'auto-inhibition des O1TP1B1/3. La pharmacocinétique du letermovir a également été caractérisée après une administration par voie orale et intraveineuse chez des receveurs de GCSH (Tableau 6) et après une administration par voie orale chez des receveurs de greffe rénale (Tableau 7).
Sujets sains
Les valeurs moyennes géométriques à l'état d'équilibre de l'ASC et de la Cmax étaient respectivement de 71 500 ng•h/mL et de 13 000 ng/mL, avec 480 mg de letermovir une fois par jour par voie orale.
Le letermovir a atteint l'état d'équilibre en 9 à 10 jours, avec un ratio d'accumulation de 1,2 pour l'ASC et 1,0 pour la Cmax.
Receveurs de GCSH
L'ASC du letermovir a été estimée à partir d'analyses de pharmacocinétique de population utilisant des données l'étude P001 de phase 3 (voir Tableau 6). Les différences d'exposition entre les schémas posologiques ne sont pas cliniquement pertinentes ; l'efficacité était maintenue sur l'ensemble de l'intervalle d'exposition observé dans P001.
Tableau 6 : Valeurs d'ASC (ng•h/mL) du letermovir chez les receveurs de GCSH
| Schéma posologique | Médiane (Intervalle de prédiction à 90 %)* |
| 480 mg par voie orale, pas de ciclosporine | 34 400 (16 900 ; 73 700) |
| 480 mg par voie intraveineuse, pas de ciclosporine | 100 000 (65 300 ; 148 000) |
| 240 mg par voie orale, avec ciclosporine | 60 800 (28 700 ; 122 000) |
| 240 mg par voie intraveineuse, avec ciclosporine | 70 300 (46 200 ; 106 000) |
| * Estimations post-hoc populationnelles réalisées à partir de l'analyse PK sur les données de l'étude dephase 3 | |
Receveurs d'une greffe rénale
L'ASC du letermovir a été estimée à l'aide d'une analyse pharmacocinétique de population utilisant les données de l'étude P002 de phase 3 (voir Tableau 7). L'efficacité était cohérente sur l'ensemble de l'intervalle des expositions observées dans P002.
Tableau 7: Valeurs d'ASC (ng•h/mL) du letermovir chez les receveurs de greffe rénale
| Schéma posologique | Médiane (Intervalle de prédiction à 90 %)* |
| 480 mg par voie orale, pas de ciclosporine | 62 200 (28 900 ; 145 000) |
| 240 mg par voie orale, avec ciclosporine | 57 700 (26 900 ; 135 000) |
| * Les médianes et les intervalles de prédiction à 90 % sont basés sur des simulations utilisant le modèle PK de population de phase 3 avec une variabilité interindividuelle.Remarque : la pharmacocinétique du letermovir n'a pas été étudiée après une administration IV chezdes receveurs de greffe rénale ; cependant, l'ASC prévisionnelle après l'administration IV est similaire à l'ASC prévue par le modèle après l'administration IV chez les receveurs de GCSH(Tableau 6). | |
Absorption
Le letermovir a été rapidement absorbé avec un délai médian jusqu'au pic de concentration plasmatique (Tmax) de 1,5 à 3,0 heures, puis a diminué en deux phases. Chez les receveurs de GCSH, la biodisponibilité du letermovir a été estimée à environ 35 % avec 480 mg de letermovir une fois par jour par voie orale, administré sans ciclosporine. La variabilité inter-individuelle de la biodisponibilité a été estimée à environ 37 %. Chez les receveurs de greffe rénale, la biodisponibilité du letermovir a été estimée à environ 60 % avec 480 mg de letermovir par voie oral une fois par jour administré sans ciclosporine.
Effet de la ciclosporine
Chez les receveurs de GCSH, la co-administration de ciclosporine a augmenté les concentrations plasmatiques de letermovir du fait de l'inhibition du OATP1B. La biodisponibilité du letermovir a été estimée
à environ 85 % avec 240 mg de letermovir une fois par jour par voie
orale, co-administré avec de la ciclosporine chez des patients.
Si le letermovir est co-administré avec la ciclosporine, la dose de
letermovir recommandée est 240 mg une fois par jour (voir rubrique Posologie et mode d'administration).
Effet des aliments
Chez des sujets sains, l'administration orale d'une dose unique de 480 mg de letermovir avec un repas standard riche en graisses et riche en calories n'a eu aucun effet sur l'exposition totale (ASC) et a donné lieu à une augmentation d'environ 30 % des pics de concentration (Cmax) de letermovir. Le letermovir peut être administré par voie orale avec ou sans aliments comme cela a été fait lors des essais cliniques (voir rubrique Posologie et mode d'administration).
Distribution
Sur
la base des analyses de pharmacocinétique de population, le volume de
distribution moyen à l'état d'équilibre est estimé à 45,5 L après administration intraveineuse chez des receveurs de GCSH.
Le letermovir est massivement lié (98,2 %) aux protéines plasmatiques humaines, indépendamment de l'intervalle des concentrations (3 à 100 mg/L) évalué in vitro.
Une certaine saturation a été observée à des concentrations plus
faibles. La répartition du letermovir entre le sang et le plasma est de
0,56 et est indépendante de l'intervalle de concentrations (0,1 à 10 mg/L) évalué in vitro.
Dans les études précliniques de distribution, le letermovir est
distribué vers les organes et tissus, les concentrations les plus
élevées étant observées dans l'appareil digestif, le canal biliaire et
le foie, et des concentrations faibles dans le cerveau.
Biotransformation
Le composé parent inchangé constitue la majorité (96,6 %) des composants du letermovir présents dans le plasma. Aucun métabolite majeur n'est détecté dans le plasma. Le letermovir est partiellement éliminé par glucuronidation médiée par UGT1A1/1A3.
Élimination
La demi-vie terminale apparente moyenne du letermovir est d'environ 12 heures après administration de 480 mg de letermovir par voie intraveineuse chez des sujets sains. Les voies d'élimination principales du letermovir sont l'excrétion biliaire ainsi que la glucuronidation directe. Le processus implique les transporteurs de captation hépatique des OATP1B1/3 puis la glucuronidation catalysée par les UGT1A1/3.
Sur la base des analyses de pharmacocinétique de population, la clairance apparente du letermovir à l'état d'équilibre est estimée à 4,84 L/h après administration intraveineuse de 480 mg chez des receveurs de GCSH. La variabilité inter-individuelle de la clairance est estimée à 24,6 %.
Excrétion
Après administration orale de letermovir radiomarqué, 93,3 % de la radioactivité a été retrouvée dans les fèces. La majorité du letermovir a été éliminée par voie biliaire sous forme du composé parent
inchangé avec une proportion minime (6 % de la dose) sous forme de métabolite acyl-glucuronide dans les fèces. L'acyl-glucuronide est instable dans les fèces. L'excrétion urinaire du letermovir était négligeable (< 2 % de la dose).
Pharmacocinétiques dans les populations particulières
Insuffisance hépatique
L'ASC du letermovir libre était respectivement d'environ
81 % et 4 fois plus élevée chez les patients présentant une
insuffisance hépatique modérée (Child-Pugh Classe B [CP-B], score de
7-9) et sévère (Child-Pugh Classe C [CP-C], score de 10-15) que chez
les sujets sains. Les modifications de l'exposition au letermovir chez les patients présentant une insuffisance hépatique modérée ne sont pas cliniquement pertinentes.
Des élévations marquées de l'exposition au letermovir libre
sont anticipées chez les patients présentant une insuffisance hépatique
modérée associée à une insuffisance rénale modérée ou sévère (voir
rubrique Posologie et mode d'administration).
Insuffisance rénale
Étude clinique dans une population présentant une insuffisance rénale
L'ASC du letermovir libre était respectivement d'environ 115 et était de 81 % plus élevée chez les patients présentant une insuffisance rénale modérée (DFGe de 31,0 à 56,8 mL/min/1,73 m2) et sévère (DFGe de 11,9 à 28,1 mL/min/1,73m2) que chez les sujets sains. Les modifications de l'exposition au letermovir en cas d'insuffisance rénale modérée ou sévère ne sont pas considérées comme cliniquement pertinentes. Les sujets atteints d'insuffisance rénale au stade terminal n'ont pas été étudiés.
Post-greffe rénale (P002)
Sur la base d'une analyse pharmacocinétique de la population, l'ASC du letermovir était plus élevée d'environ 12 %, 27 % et 35 % chez les sujets présentant une insuffisance rénale (ClCr supérieure ou égale à 60 et inférieure à 90 mL/min), modérée (ClCr supérieure ou égale à 30 ml/min et inférieure à 60 mL/min) et sévère (ClCr supérieure ou égale à 15 et inférieure à 30 mL/min), respectivement, comparée aux sujets présentant une ClCr supérieure ou égale à 90 mL/min. Ces changements ne sont pas considérés comme cliniquement pertinents.
Poids
Sur la base des analyses de pharmacocinétique de population chez des sujets sains, l'ASC estimée du letermovir est plus faible de 18,7 % chez les patients pesant 80-100 kg que chez les patients pesant 67 kg. Sur la base d'une analyse pharmacocinétique de population chez des receveurs de greffe rénale (P002), l'ASC du letermovir est estimée être inférieure de 26 % chez les patients pesant plus de 80 kg par rapport aux patients pesant 80 kg ou moins. Ces différences ne sont pas cliniquementpertinentes.
Origine ethnique
Sur la base des analyses de pharmacocinétique de population chez des sujets sains, l'ASC estimée du letermovir est plus élevée de 33,2 % chez les sujets de type asiatique que chez les sujets de type caucasien. Cette modification n'est pas cliniquement pertinente.
Sexe
Sur la base des analyses de pharmacocinétique de population, il n'y a pas de différence dans la pharmacocinétique du letermovir entre les patients de sexe masculin et féminin.
Sujets âgés
Sur la base des analyses de pharmacocinétique de population, il n'y a pas d'effet lié à l'âge sur la pharmacocinétique du letermovir. Aucune adaptation posologique n'est nécessaire en fonction de l'âge.
PREVYMIS peut avoir une influence mineure sur l'aptitude à conduire ou à utiliser des machines. Une fatigue et des vertiges ont été rapportés chez certains patients pendant le traitement par PREVYMIS, pouvant avoir une influence sur l'aptitude du patient à conduire et à utiliser des machines (voir rubrique Effets indésirables).
Toxicité générale
Une toxicité testiculaire irréversible a été observée uniquement chez les rats à des niveaux d'exposition systémique (ASC) au moins 3 fois supérieurs aux expositions observées chez l'Homme à la dose recommandée chez l'Homme (DRH). Cette toxicité a été caractérisée par une dégénérescencedes tubes séminifères, une oligospermie et la présence de débris cellulaires dans les épididymes, avec une baisse du poids des testicules et des épididymes. Il n'y a pas de toxicité testiculaire chez le rat à des expositions (ASC) similaires aux expositions obtenues chez l'Homme à la DHR. Aucune toxicité testiculaire n'a été observée chez la souris et le singe aux doses maximales testées, avec des expositions respectivement jusqu'à 4 fois et 2 fois supérieures aux expositions observées chez l'Homme à la DRH. La pertinence chez l'Homme est inconnue.
On sait que l'hydroxypropylbetadex peut provoquer une vacuolation du rein chez le rat après administration par voie intraveineuse de doses supérieures à 50 mg/kg/jour. Une vacuolation avait été observée dans les reins des rats ayant reçu par voie intraveineuse du letermovir formulé avec 1500 mg/kg/jour d'hydroxypropylbetadex, excipient de la cyclodextrine.
Cancérogenèse
Une étude de cancérogenèse par voie orale de 6 mois chez des souris transgéniques RasH2 (Tg.RasH2) n'a montré aucune preuve de tumorigenèse pertinente pour l'homme jusqu'aux doses les plus élevées testées, 150 mg/kg/jour et 300 mg/kg/jour respectivement chez les mâles et les femelles.
Mutagenèse
Le letermovir n'a pas été génotoxique dans une batterie d'essais in vitro ou in vivo, incluant les essais de mutagenèse microbienne, d'aberrations chromosomiques sur cellules d'ovaire de hamster chinois et dans une étude in vivo des micronoyaux chez la souris.
Reproduction
Fertilité
Dans les études sur la fertilité et le développement précoces de l'embryon chez le rat, aucun effet du letermovir n'a été observé sur la fertilité des femelles. Chez les rats mâles, une baisse de laconcentration des spermatozoïdes, une baisse de la motilité des spermatozoïdes et une baisse de la fertilité ont été observées à des niveaux d'exposition systémique au moins 3 fois supérieurs à l'ASC chez l'Homme à la DRH (voir « Toxicité générale »).
Chez des singes ayant reçu du letermovir, il n'y a eu aucune preuve de toxicité testiculaire par évaluation histopathologique, mesure de la taille des testicules, analyse des hormones sanguines (hormone folliculo-stimulante, inhibine B et testostérone) et par évaluation des spermatozoïdes (nombre, motilité et morphologie des spermatozoïdes) à des niveaux d'exposition systémique environ 2 fois supérieurs à l'ASC chez l'Homme à la DRH.
Développement
Une toxicité maternelle chez les rats (y compris une diminution de la prise de poids) a été observée à 250 mg/kg/jour (environ 11 fois l'ASC à la DRH) ; chez la progéniture, une baisse du poids du fœtus avec un retard d'ossification, des fœtus légèrement œdémateux et une incidence accrue de cordons ombilicaux courts et de variations et malformations des vertèbres, des côtes et du pelvis ont été observés. Aucun effet sur la mère ou sur le développement n'a été observé à la dose de 50 mg/kg/jour (environ 2,5 fois l'ASC à la DRH.).
Une toxicité maternelle chez des lapins (y compris mortalité et avortements) a été observée à 225 mg/kg/jour (environ 2 fois l'ASC à la DRH) ; chez la progéniture, une incidence accrue de malformations et de variations des vertèbres et des côtes a été observée.
Dans l'étude de développement pré- et post-natal, le letermovir a été administré par voie orale à des rats femelles gestantes. Aucune toxicité sur le développement n'a été observée jusqu'à l'exposition la plus élevée testée (2 fois supérieure à l'ASC à la DRH).
Les flacons de PREVYMIS sont exclusivement à usage unique.
Préparation
Les instructions de préparation et d'administration sont identiques quelle que soit la dose.
PREVYMIS
solution à diluer pour perfusion doit être dilué avant utilisation par
voie intraveineuse.
Examiner le contenu du flacon à la recherche d'une
décoloration et de particules avant dilution.
PREVYMIS
solution à diluer pour perfusion est une solution limpide, incolore et
peut contenir quelques petites particules translucides ou blanches
liées au produit. Ne pas utiliser le flacon si la solution est trouble,
présente une décoloration ou contient des matières autres que quelques
petites particules translucides ou blanches.
Ne pas utiliser PREVYMIS solution à diluer pour perfusion avec des poches intraveineuses et matériaux des sets de perfusion contenant du polyuréthane ou du plastifiant phtalate de diéthylhexyle (DEHP). Les matériaux sans phtalate sont aussi sans DEHP.
Ne pas secouer le flacon de PREVYMIS.
Ajouter un flacon à dose unique (soit 12 mL (dose de 240 mg) soit 24 mL (dose de 480 mg)) de PREVYMIS solution à diluer pour perfusion dans une poche intraveineuse de 250 mL préremplie contenant soit du chlorure de sodium 9 mg/mL (0,9 %) solution pour injection soit du glucose à 5 % et mélanger la solution diluée par inversion délicate. Ne pas secouer.
Une fois diluée, la solution de PREVYMIS est limpide, d’incolore à jaune. Les variations au sein de cette gamme de couleur n’affectent pas la qualité du produit. La solution diluée doit être examinée visuellement avant administration à la recherche de particules et d’une décoloration. Jeter le contenu si la solution diluée est trouble, présente une décoloration ou contient des matières autres que quelques petites particules translucides ou blanches. Si un flacon est ajouté dans une poche intraveineuse de 250 mL de diluant, la concentration finale de letermovir serait de 0,9 mg/mL (pour une dose de 240 mg) et 1,8 mg/mL (pour une dose de 480 mg).
Administration Voir rubrique Posologie et mode d'administration.
La solution diluée de PREVYMIS doit être administrée à travers un filtre en ligne stérile en polyéthersulfone (PES) de 0,2 microns ou 0,22 microns.
Solutions intraveineuses et autres médicaments compatibles
PREVYMIS solution à diluer pour perfusion est compatible avec les solutions de chlorure de sodium à 0,9 % et de glucose à 5 %.
PREVYMIS ne doit pas être administré simultanément par la même ligne intraveineuse (ou cathéter) avec d'autres médicaments et associations de solvants, à l'exception de ceux listés ci-dessous.
Liste des médicaments compatibles lorsque PREVYMIS et ces médicaments* sont préparés dans du chlorure de sodium à 0,9 %
* Se référer au RCP pour confirmer la compatibilité de la co-administration simultanée.
Liste des médicaments compatibles lorsque PREVYMIS et ces médicaments* sont préparés dans du glucose à 5 %
* Se référer au RCP pour confirmer la compatibilité de la co-administration simultanée.
† L'amphotéricine B (complexe lipidique) est compatible avec PREVYMIS. Cependant, l'amphotéricine B (liposomale) est incompatible (voir rubrique Incompatibilités).
† L'amphotéricine B (complexe lipidique) est compatible avec PREVYMIS. Cependant, l'amphotéricine B (liposomale) est incompatible (voir rubrique Incompatibilités).
Poches intraveineuses et matériaux des sets de perfusion compatibles
PREVYMIS est compatible avec les poches intraveineuses et les matériaux des sets de perfusion suivants. Toute poche intraveineuse ou tout matériau des sets de perfusion non listés ci-dessous ne doivent pas être utilisés.
Matériaux des poches intraveineuses
Chlorure de polyvinyle (PVC), éthylène-acétate de vinyle (EVA) et polyoléfine (polypropylène et polyéthylène)
Matériaux des sets de perfusion
PVC, polyéthylène (PE), polybutadiène (PBD), caoutchouc de silicone (SR), copolymère styrène- butadiène (SBC), copolymère styrène-butadiène-styrène (SBS), polystyrène (PS)
Plastifiants
Tris (2-etylhexyl) trimellitate (TOTM), phtalate de butyle benzyle (BBP)
Cathéters
Polyuréthane radio-opaque
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Prescription hospitalière.
Solution à diluer pour perfusion (concentré stérile)
Liquide limpide, incolore pH entre 7 et 8
Flacon en verre clair de type I (30 mL) muni d'un bouchon de 20 mm en chlorobutyle recouvert de fluor et d'un capuchon flip-off en aluminium contenant 12 mL (bouchon vert) de solution.
Présentation : 1 flacon.
Chaque flacon contient 240 mg (12 mL par flacon) de letermovir.
Chaque mL contient 20 mg de letermovir.
Excipients à effet notoire
Ce médicament contient 23 mg (1 mmol) de sodium par flacon à 240 mg.
Chaque dose de 240 mg (flacon de 12 mL) de ce médicament contient 1 800 mg d'hydroxypropylbetadex (cyclodextrine).
Pour plus d'informations, voir rubrique Posologie et mode d'administration.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Hydroxypropylbetadex (cyclodextrine)
Chlorure de sodium
Hydroxyde de sodium (E524)
Eau pour préparations injectables